De nobelprijs in een notendop
Het is 7 oktober 2019. William G. Kaelin Jr, Sir Peter J. Ratcliffe en Gregg L. Semenza krijgen de Nobelprijs voor Fysiologie of Geneeskunde uitgereikt en  daarmee ieder zo’n €275 000 (3 miljoen Zweedse Kronen) op hun bankrekening erbij. Deze drie heren deden jaren lang onderzoek naar de invloed van de beschikbaarheid van zuurstof op cellen (en organismen) en diens aanpassingen hierop. Het is natuurlijk onze taak om op de hoogte te zijn van de belangrijkste medisch-wetenschappelijke ontwikkelingen, maar in het drukke leven van een student is dat natuurlijk niet altijd even makkelijk. Hier is een hopelijk begrijpelijke samenvatting van hun werk.
daarmee ieder zo’n €275 000 (3 miljoen Zweedse Kronen) op hun bankrekening erbij. Deze drie heren deden jaren lang onderzoek naar de invloed van de beschikbaarheid van zuurstof op cellen (en organismen) en diens aanpassingen hierop. Het is natuurlijk onze taak om op de hoogte te zijn van de belangrijkste medisch-wetenschappelijke ontwikkelingen, maar in het drukke leven van een student is dat natuurlijk niet altijd even makkelijk. Hier is een hopelijk begrijpelijke samenvatting van hun werk.
Om een vrij ingewikkeld onderwerp redelijk te bevatten te maken begin ik met een voorbeeld uit de sportwereld. In veel takken van sport gaan sporters voor een belangrijk toernooi of een belangrijke wedstrijd op hoogtestage. De theorie hierachter is gebaseerd op de aanpassingen van het lichaam als gevolg van een verandering in het aanbod van zuurstof. Op grotere hoogtes zit er minder zuurstof in de lucht, maar het lichaam wil wel voldoende zuurstof binnen krijgen dus gaat het compenseren door meer van de zuurstof in de ingeademde lucht de bloedbaan in te krijgen. Een hormoon uit de nieren, erytropoëtine (EPO) wordt aangemaakt als respons op de lage zuurstofdruk in het bloed. EPO stimuleert de aanmaak van rode bloedcellen. Bij een hoger aantal rode bloedcellen kan er meer zuurstof vastgehouden worden in het bloed en kan er dus een groter gedeelte van de zuurstof uit de ingeademde lucht de bloedbaan in treden.
Sporters gaan dus op hoogtestage en komen terug met een hoger EPO gehalte in hun bloed en daarmee ook meer rode bloedcellen. Wanneer ze in een lager gebied zijn met meer zuurstof in de lucht, krijgen ze dus nog meer zuurstof binnen dan voorheen en zullen zo hun prestaties verbeteren. Niets duurt echter voor eeuwig, door het grotere aanbod zuurstof zal de EPO concentratie dalen en zal ook het aantal rode bloedcellen weer normaliseren.
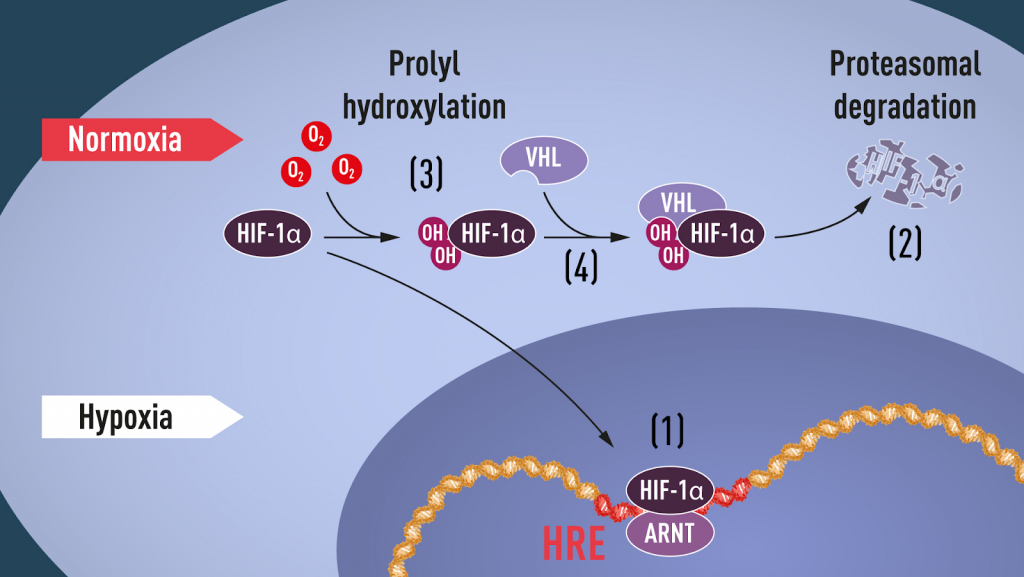
Dit effect was al bekend sinds het einde van de 19e eeuw. Meerdere onderzoekers hebben ruim een eeuw later ontdekt dat het gen verantwoordelijk voor EPO onder hypoxische toestanden een verhoogde genexpressie had. Semenza deed onderzoek naar het EPO gen en ontdekte dat er een plus minus 50 basen paar lang enhancer gedeelte zat aan het 3’ einde van het EPO gen dat gestimuleerd werd onder hypoxische omstandigheden. Semenza noemde deze enhancer een ‘hypoxia response element’ (HRE). Deze enhancer kon enkele factoren binden, waaronder één die gevonden werd in zuurstofarme situaties, deze werd ‘hypoxia inducible factor’ (HIF) genoemd. In het kort zorgt HIF dus voor EPO en dus voor meer rode bloedcellen om meer zuurstof het lichaam binnen te krijgen.
Als we een heel stuk doorspoelen in het verhaal, komen we nog een ander speler tegen: VHL. VHL is een tumorsuppressorgen, het eiwit wat hier uit voort komt zorgt voor de afbraak van eiwitten. Kaelin toonde aan dat de doelwit genen van HIF een verhoogde expressie hadden in VHL-gemuteerde cellijnen. Dit wil dus zeggen dat als VHL niet goed werkt, dat HIF zich gaat opstapelen. Het was dus toen aanneembaar dat VHL ergens verantwoordelijk was voor de afbraak van HIF.
Dat bleek het geval te zijn. In omstandigheden met voldoende zuurstof ging een enzym -OH groepen toevoegen aan HIF. Door deze groepen kon het VHL eiwit aan HIF binden en deze uiteindelijk afbreken. Voor het vormen van de -OH groep is zuurstof nodig, en dit is de belangrijke stap in het zuurstof-afhankelijke regulatie mechanisme van onder andere EPO. Zonder zuurstof kan er geen -OH aan HIF gebonden worden, waardoor VHL het niet kan afbreken en gaat HIF zijn werk doen om het lichaam aan te passen aan deze zuurstofarme omgeving.
Dus mede dankzij deze drie mannen hebben we nu een beter begrip hoe het lichaam zich aanpast aan de hoeveelheid zuurstof die beschikbaar is, maar wat kunnen we hier nu eigenlijk mee?
Recent onderzoek heeft aangetoond dat het remmen van het enzym dat -OH groepen aan HIF toevoegt voor afbraak, hemoglobine waardes in patiënten met anemie als gevolg van nierziekten verhoogt. Dus doordat deze pathway nu bekend is, kunnen er farmacologische interventies ontwikkeld worden voor ziekten die te maken hebben met het eindresultaat (zuurstof balans).
Naast het kunstmatig stimuleren van HIF-werking, kan de pathway ook geremd worden. Kaelin en zijn collega’s hebben in 2016 aangetoond dat het remmen van een factor in de HIF familie (voor de eenvoud heb ik HIF als één factor omschreven maar in de werkelijkheid is het een familie van vergelijkbare factoren) baat heeft bij het vertragen van tumorgroei VHL-gemuteerde cellen.
Deze Nobelprijs is dus niet gegaan naar een revolutie in de manier waarop we patiënten behandelen, maar juist naar de theoretische achtergrond waarop in de toekomst voortgebouwd kan worden om nieuwe behandelingsmogelijkheden te ontwikkelen. Deze samenvatting doet natuurlijk geen recht aan het onderzoek dat deze drie mannen en de tientallen (honderden?) mensen achter de schermen hebben gedaan naar dit onderwerp. Ik wil jullie daarom van harte aanraden om een kijkje te nemen op de onderstaande site van de Nobel Foundation om meer te leren over het onderwerp. Ook staan hier referenties naar alle onderzoeken waar naar verwezen is in dit artikel.
Zo’n prijs winnen is natuurlijk leuk, jarenlang keihard werken wordt beloond. Je levenswerk krijgt de herkenning die het verdient, die uren op uren zwoegen in het lab zijn het eindelijk waard. Maar ik kan zelf alleen maar denken wat een killer competentiekaart Academicus je hiervan kunt maken.
Illustrations: © The Nobel Committee for Physiology or Medicine. Illustrator: Mattias Karlén
Dit vind je waarschijnlijk ook leuk: https://www.msvpulse.nl/bijzondere-medicus-jonathan-kim/